Belajar Kimia-Tahun 1911, Fisikawan Inggris Ernest Rutherford dan 2 temannya Geiger dan Marsden melakukan eksperimen “penghamburan partikel alfa oleh selaput tipis emas (0,0004 mm)” dengan hasil sebagai berikut:
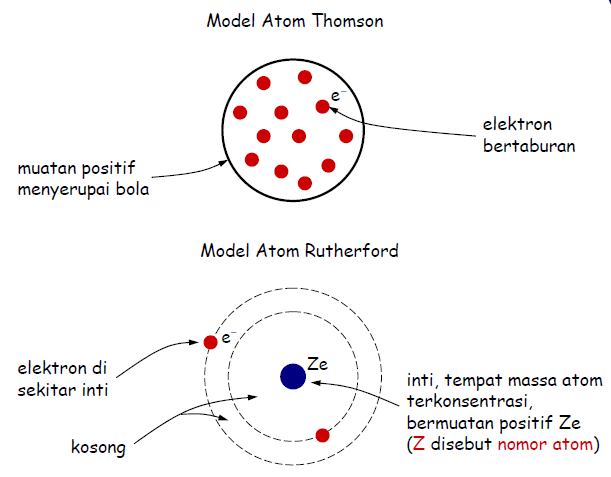
■ Sebagian besar partikel alfa menembus selaput tipis emas. Berarti, sebagian besar atom adalah ruang kosong.
■ Sedikit dari partikel alfa (yang bermuatan positif) dibelokkan keluar oleh sesuatu. hal ini menunjukkan adanya sesuatu yang bermuatan positif yang dapat membelokkan partikel alfa.
■ Lebih sedikit lagi dari partikel alfa itu (hanya 1 dari 20.000) terpantul dari selaput tipis emas. Hal ini menunjukkan adanya sesuatu yang sangat kecil (belakangan disebut sebagai inti), namun massa terpusat di sana sehingga partikel alfa yang menumbuk pusat massa itu akan terpantulkan
■ Sebagian besar ruangan dalam atom merupakan ruangan kosong.
■ Atom terdiri atas inti atom bermuatan positif dan hampir seluruh massa atom terpusat pada inti.
■ Elektron beredar mengelilingi inti.
■ Jumlah muatan inti sama dengan jumlah muatan elektron sehingga atom bersifat netral.
Beberapa kelebihan dan kelemahan model atom Rutherford adalah sebagai berikut:
■ Dapat menerangkan fenomena penghamburan partikel alfa oleh selaput tipis emas.
■ Mengemukakan keberadaan inti atom yang bermuatan positif dan merupakan pusat massa atom.
Kekurangan Model Atom Rutherford
■ Bertentangan dengan teori elektron dinamika klasik, di mana suatu partikel bermuatan listrik apabila bergerak akan memancarkan energi.
■ Elektron bermuatan negatif yang beredar mengelilingi inti akan kehilangan energi terus-menerus sehingga akhirnya akan membentuk lintasan spiral dan jatuh ke inti. Pada kenyataannya hal ini tidak terjadi, elektron tetap stabil pada lintasannya.
Hamburan Rutherford
Belajar inti atom (nuklir), berarti kita belajar dari bagaimana dulu perkembangan model atom itu sendiri. Dari mulai model yang sangat sederhana yang mengatakan bahwa atom adalah elemen terkecil dari suatu benda yang tidak bisa dibagi-bagi lagi, hingga kemudian model atom Thomson, Rutherford, hingga model kuantum.
Salah model yang pernah diterima adalah model atom Rutherford. Untuk mempelajari struktur atom, pada tahun 1911 Rutherford membuat eksperimen menembakkan partikel alfa ke lembar tipis emas. Saat itu masih dipercaya model atom Thomson. Menurut model ini, diperkirakan partikel alfa akan dibelokkan hanya sedikit saja. Namun ternyata, ada juga partikel alfa yang dihamburkan balik ke belakang (sudut hambur besar).
Eksperimen ini menunjukkan bahwa model atom Thomson salah dan membawa Rutherford pada model atom yang lebih baik yaitu, atom memiliki inti di pusat yang merupakan konsentrasi seluruh massa atom, sementara di sekeliling inti beredar elektron-elektron. Partikel alfa yang lewat dekat dari inti emas akan dibelokkan dengan kuat, sementara yang lewat jauh dari inti emas dibelokkan sedikit.


_page-0025.jpg)




