Belajar Kimia-Spektroskopi NMR (Resonansi Magnetik Inti) adalah salah satu cabang dari spektroskopi absorbsi yang menggunakan radiasi frekuensi gelombang radio untuk menginduksi terjadinya transisi antara dua tingkat energi spin suatu inti yang mempunyai momen magnetik inti bukan nol.
Resonansi magnetik inti mempunyai kaitan dengan sifat-sifat magnetik suatu inti tertentu
Suatu
kompas jarum, biasanya akan mengarah pada medan magnet bumi dengan arah utara.
Jika jarum kompas tersebut anda putar dengan jari sehingga menunjukkan arah
selatan – arah yang berlawanan dengan medan magnet bumi. Posisi ini sangat
tidak stabil karena berlawanan dengan arah medan magnet bumi, dan jika anda
membiarkannya jarum akan segera kembali ke posisi semula yang lebih stabil.
Inti hidrogen juga mempunyai perilaku seperti magnet kecil
Inti hidrogen dapat juga diatur arahnya agar sesuai dengan arah medan magnet luar atau berlawanan dengan arah medan magnet luar. Arah yang berlawanan dengan medan adalah tak stabil (energinya tinggi).
Ini memungkinkan untuk mengubah arahnya dari yang lebih stabil ke kurang stabil dengan memberikan energi yang sesuai.
Banyak inti (inti yg jumlah proton atau neutronnya ganjil) dapat dianggap sebagai magnet kecil.
Inti seperti proton (1H) dan inti karbon (13C)
Bila sampel yang mengandung 1H atau 13C (bahkan semua senyawa organik) ditempatkan dalam medan magnet, akan timbul interaksi antara medan magnet luar tadi dengan magnet kecil (inti). Karena ada interaksi ini, magnet kecil akan terbagi atas dua tingkat energi (tingkat yang sedikit agak lebih stabil (+) dan keadaan yang kurang stabil (-) yang energinya berbeda.
Suatu inti atom dengan jumlah proton ganjil mempunyai muatan dan spin, sehingga mempunyai momen magnetik. Dalam sekumpulan atom, orientasi spinnya dalam ruang berada dalam keadaan acak. Namun demikian, jika diletakkan dalam medan magnet, momen magnet tersebut akan terorientasi, umpamanya inti hidrogen mempunya dua orientasi yang mungkin, yaitu satu spin searah dan yang lainnya berlawanan arah dengan medan magnet luar. Kedua orientasi tersebut mempunyai perbedaan energi (delta E) yang sangat kecil.
Perbedaan energi antara dua keadaan tsb:
E = γhH/2π
H = kuat medan magnet luar
h = tetapan Planck
γ = rasio giromagnetik (2,6752 x 108 kg-1 s A)
Bila sampel disinari dengan gelombang elektromagnetik ν yang berkaitan dengan perbedaan energi E, yakni,
E = hν
Inti dalam keadaan (+) mengabsorbsi energi ini dan tereksitasi ke tingkat energi (-).
Proses mengeksitasi inti dalam medan magnetik akan mengabsorbsi energi (resonansi) disebut nuclear magnetic resonance (NMR)
Frekuensi gelombang elektromagnetik yang diabsorbsi diungkapkan sebagai fungsi H.
ν = γH/2π
Bila kekuatan medan magnet luar, yakni magnet spektrometer, adalah 2,3490 T (tesla; 1 T = 23490 Gauss), ν yang diamati sekitar 1 x 108 Hz = 100 MHz, nilai frekuensi ini di daerah gelombang mikro.
Frekuensi gelombang elektromagnetik yang diserap ditentukan oleh kekuatan magnet dan jenis inti yang diamati. Namun, perubahan kecil dalam frekuensi diinduksi oleh perbedaan lingkungan kimia tempat inti tersebut berada. Perubahan ini disebut pergeseran kimia (chemical shift).Pergeseran kimia
adalah pemisahan frekuensi resonansi suatu inti dari frekuensi resonansi suatu standar [biasanya TMS (Tetra Metil Silan) [Si(CH3)4]
TMS dipilih sebagai standar karena beberapa alasan, diantaranya:
TMS mempunyai 12 atom hidrogen yang semuanya memiliki lingkungan kimia yang sama. Mereka terikat oleh atom yang sama dengan cara yang sama sehingga tidak hanya menghasilkan puncak tunggal tetapi juga puncak yang kuat (karena ada banyak atom hidrogen).
Hidrogen pada senyawa ini lebih terlindungi dibandingkan pada senyawa lain karena adanya elektron-elektron ikatan C-H. Ini artinya inti hidrogen lebih terlindungi dari medan magnet luar, untuk membawa hidrogen ini kembali ke kondisi resonansinya, medan magnetnya harus ditingkatkan.
Pergeseran kimia (chemical shift)
dihitung parts per million – ppm.
Suatu puncak dengan pergeseran kimia, misalnya 2.0 artinya atom-atom hidrogen
yang memunculkan puncak tersebut memerlukan medan magnet 2 juta lebih kecil
dari medan yang dibutuhkan oleh TMS untuk menghasilkan resonansi.
Suatu puncak pada pergeseran kimia 2.0 dikatakan mempunyai medan lebih rendah
dari TMS (downfiled).
Dalam spektroskopi 1H NMR, pergeseran kimia diungkapkan sebagai nilai relatif terhadap frekuensi absorpsi (0 Hz) tetrametilsilan standar (TMS) (CH3)4Si
Pergeseran kimia tiga jenis proton dalam etanol CH3CH2OH
Nilai δ didefinisikan sebagai berikut.
δ = ( ν/ν) x 106 (ppm)
ν perbedaan frekuensi resonansi (dalam Hz) inti yang diselidiki dari frekuensi standar TMS (dalam banyak kasus) dan ν frekuensi (dalam Hz) proton ditentukan oleh spektrometer yang sama.
Hz yang muncul di pembilang dan penyebut persamaan di atas dan oleh karena itu saling meniadakan. Karena nilai ν/ν sedemikian kecil, nilainya dikalikan dengan 106. Jadi nilai δ satuannya ppm.
Untuk sebagian besar senyawa, nilai δ proton dalam rentang 0-10 ppm. Nilai δ tiga puncak etanol digambar adalah 1,15; 3,6 dan 5,4
Kopling spin-spin
Tingkat energi inti (yakni, proton) terbelah menjadi keadaan berenergi tinggi dan rendah. Selain itu, tingkat-tingkat energi ini membelah lebih lanjut karena interaksi dengan inti tetangganya (inti-inti adalah magnet-magnet sangat kecil juga). Pembelahan ini sangat kecil tetapi akan memiliki akibat yang penting,. Pembelahannya hanya bergantung pada interaksi inti-inti.
Bila spektrum 1H NMR etanol diukur dengan kondi si lebih baik (uakni resolusi lebih baik), sinyal CH3- dan CH2- tebelah menjadi multiplet
Pembelahan ini karena adanya kopling spin-spin antar proton. Spektra yang menunjukkan pembelahan kopling spin-spin ini disebut spektra resolusi tinggi. Sedang spektra yang tidak menunjukkan pembelahan ini disebut spektra resolusi rendah.
Pelarut untuk spektroskopi RMI
Pelarut yang digunakan tidak boleh mengandung atom hidrogen,
karena adanya atom hidrogen pada pelarut akan mengganggu puncak-puncak
spektrum.
Ada dua cara untuk mencegah gangguan oleh pelarut. Anda dapat menggunakan
pelarut seperti tetraklorometana, CCl4, yang tidak mengandung hidrogen, atau
anda dapat menggunakan pelarut yang atom-atom hidrogennya telah diganti dengan
isotopnya, deuterium, sebagai contoh CDCl3 sebagai ganti CHCl3. Semua spektrum
RMI pada bagian ini menggunakan CDCl3 sebagai pelarut.
Atom-atom deuterium mempunyai sifat-sifat magnetik yang sedikit berbeda dari
hidrogen, sehingga mereka akan menghasilkan puncak pada area spektrum yang
berbeda.
Penggabungan spin (spin coupling) dan Pemisahan spin (spin splitting)
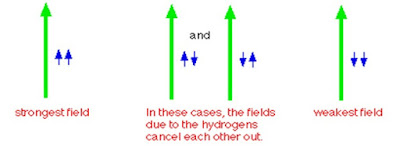
Hidrogen tetangga mempunyai medan magnet lemah yang dapat searah ataupun berlawanan dengan medan magnet luar. Tergantung pada arahnya, yang akan memperkuat atau melemahkan medan yang dirasakan oleh hidrogen-hidrogen pada CH2.
Penggabungan SPIN
Mengapa triplet?
Hal ini karena hidrogen mempunyai tiga medan magnet yang sedikit berbeda.
Dua susunan di bagian tengah diagram menghasilkan medan yang sama (sama
dengan medan magnet luar). Sehingga, ada tiga medan magnet yang mungkin yang
dapat dirasakan oleh hidrogen CH, dan menyebabkan ada tiga puncak – suatu
triplet.
Luas area di bawah puncak mempunyai perbandingan 1 : 2 : 1 hal ini menunjukkan
peluang dari medan magnet yang ada.
Kuartet
Susunan hidrogen CH3
Semua susunan pada baris kedua menghasilkan medan yang sama, dan semua
susunan pada baris ketiga juga menghasilkan medan yang sama, tetapi waktunya
sedikit lebih kecil. Ada empat medan yang berbeda, dengan perbandingan
peluangnya 1 : 3 : 3 : 1.
Sehingga hidrogen yang bertetangga dengan gugus CH3 akan memberikan puncak
kuartet pada spektrumnya, dengan ukuran perbandingan puncak 1 : 3 : 3 : 1.
Pemecahan Spin-spin (Splitting)
Posisi resonansi suatu proton dapat dipengaruhi oleh spin proton-proton yang ada di sebelahnya. Juga suatu proton dapat membuat suatu perubahan kecil dalam penamengan proton tetangganya melalui ikatan elektronik, maka akan terjadi pemecahan spin-spin atau pembentukan pasangan spin (spin coupling). Meskipun proton A dan proton B yang terikat pada dua karbon yang berdekatan letaknya terlalu berjauhan untuk dapat saling mempengaruhi medan magnetnya melalui ruang, namun proton A dapat mempolarisasikan awan elektron di sekitarnya dan polarisasi ini dapat ditransmisikan melalui sistem ikatan ke proton B.
Untuk pemecahan order pertama, secara umum suatu puncak akan pecah menjadi ( n+1 ) pucak karena pengaruh dari n proton tetangganya (yaitu H yang terikat pada atom-atom C disebelahnya) yang ekivalen.
Perbandingan luas puncaknya (intensitasnya) dapat dinyatakan sebagai koefisien dari ( a+b )n atau seperti segitiga Pascal.
n intensitas relatif
0 1
1 1 1
2 1 2 1
3 1 3 3 1
4 1 4 6 4 1
CARBON-13 NMR
Banyak molekul yang dipelajari oleh NMR mengandung karbon. Sayangnya, karbon-12 inti tidak memiliki spin, tetapi karbon-13 (C-13) nukleus tidak karena adanya neutron yang berpasangan. Karbon-13 Oleh karena itu, karbon-13 spektroskopi NMR akan kurang sensitif daripada hidrogen spektroskopi NMR.
spin-spin coupling antara inti karbon-13 dan inti atom hidrogen yang berikatan dengan karbon-13, membagi puncak karbon-13 menyebabkan sinyal - to-noise ratio kurang bagus Masalah ini dapat diatasi dengan menggunakan teknik yang dikenal sebagai decoupling