Belajar Kimia - Termokimia adalah ilmu yang mempelajari reaksi kimia dan perubahan energi yang terlibat. Dalam mempelajari termokimia, diperlukan definisi “sistem” dan “lingkungan”. Sistem adalah segala sesuatu yang menjadi fokus perhatian kita. Lingkungan adalah segala sesuatu selain sistem.
Hukum pertama termodinamika menyatakan bahwa energi tidak dapat diciptakan ataupun dimusnahkan. Implikasi hukum ini pada energi dalam sistem, yaitu perubahan energi dalam, ΔE sama dengan penjumlahan kalor (q) yang diserap atau dilepas sistem dengan kerja (w) yang dilakukan atau diterima sistem.
Sebelum membahas lebih jauh tentang termokimia, mari kita lihat dulu tentang Hukum Kekekalan, Energi dan Sistem.
1. Hukum Kekekalan Energi
Hukum kekekalan energi dikenal dengan hukum Termodinamika I yang berbunyi : “ Energi dapat diubah, tetapi tidak dapat dimusnahkan. “
2. Sistem Dan Lingkungan
a. Sistem adalah bagian dari obyek yang sedang diamati Sistem kimia adalah campuran pereaksi yang kita amati
b. Lingkungan adalah bagian diluar sistem
c. Jenis Sistem
1. Sistem terbuka : jika antara sistem dan lingkungan dapat mengalami pertukaran materi dan energi.
2. Sistem tertutup : jika antara sistem dan lingkungan tidak dapat terjadi pertukaran materi, tetapi terjadi pertukaran energi.
3. Sistem terisolasi : jika antara sistem dan lingkungan tidak terjadi
pertukaran materi dan energi.
Reaksi Endoterm dan Eksoterm
Berdasarkan adanya perpindahan energi antara sistem dan lingkungan,
reaksi termokimia dikelompokan menjadi reaksi eksoterm dan reaksi
endoterm.
Reaksi Eksoterm
Reaksi Eksoterm adalah reaksi kimia yang menghasilkan kalor. Pada reaksi ini, terjadi perpindahan kalor dari sistem ke lingkungan sehingga lingkungan menjadi lebih lebih panas. Tanda reaksi eksoterm adalah perubahan entalpi bernilai negatif (∆H = - ). Hal ini dikarenakan reaksi eksoterm akan membebaskan energi sehingga entalpi sistem berkurang.
Jadi jika kita breakdown maka Reaksi Eksoterm adalah
1. Reaksi yang membebaskan kalor
2. Suhu sistem > suhu lingkungan
3. Kalor berpindah dari sistem ke lingkungan
4. Disertai kenaikan suhu.
5. Penulisan persamaan reaksinya sbb :
Reaksi A + B ----> C dibebaskan kalor 10 kj
Persamaan Reaksi :
A + B ----->C + 10 kj
r = p + 10 kj
r > p
ΔH = Hp - Hr
kecil - besar
ΔH = -
Diagram tingkat energi pada reaksi :
A + B ----> C
Reaksi Endoterm
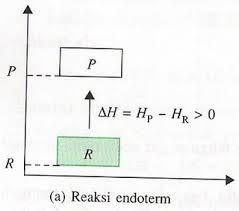
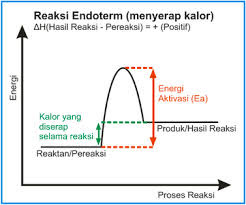
Reaksi endoterm adalah reaksi yang menyerap kalor (terjadi perpindahan kalor dari lingkungan ke sistem). Reaksi endoterm (endo-adalah awalan yang berarti "ke dalam"), di mana kalor harus disalurkan ke sistem oleh lingkungan.
Pada reaksi ini, terjadi perpindahan kalor dari lingkungan ke sistem sehingga suhu lingkungan turun dan menjadi lebih dingin. Reaksi endoterm menyerap sejumlah energi sehingga energi sehingga energi sistem bertambah. Karena entalpi bertambah, perubahan entalpinya bertanda positif.
Dapat dijelaskan dengan gambar sebagai berikut:
Pada reaksi endoterm, sistem menyerap energi. Oleh karena itu, entalpi sistem akan bertambah. Artinya, entalpi produk (Hp) lebih besar daripada entalpi pereaksi (Hr). Akibatnya, perubahan entalpi, merupakan selisih antara entalpi produk dengan entalpi pereaksi (Hp-Hr) bertanda positif. Dan dapat dinyatakan perubahan entalpi untuk reaksi endoterm sebagai berikut:
∆H = Hp-Hr > 0 (Positif)
Serta dapat
dijelaskan secara rinci dengan gambar sebagai berikut:
Jadi jika kita breakdown maka Reaksi Endoterm adalah
1. Reaksi yang memerlukan kalor
2. Suhu sistem C
A + B ---->C - 25 kj
C diserap kalor 25 kj
r = p - 25 kj
r < h =" Hp">il ΔH = +
Penentuan Entalpi Reaksi
Penentuan ∆H Reaksi berdasarkan Eksperimen
(Kalorimeter)
Penentuan kalor reaksi secara kalorimetris merupakan penentuan yang didasarkan atau diukur dari perubahan suhu larutan dan kalorimeter dengan prinsip perpindahan kalor, yaitu jumlah kalor yang diberikan sama dengan jumlah kalor yang diserap.
Kalorimeter
adalah suatu sistem terisolasi (tidak ada pertukaran materi maupun energi
dengan lingkungan di luar kalorimeter). Dengan demikian, semua kalor yang
dibebaskan oleh reaksi yang terjadi dalam kalorimeter, kita dapat menentukan
jumlah kalor yang diserap oleh air serta perangkat kalorimeter berdasarkan
rumus :
q.larutan = m c ∆T
q.kalorimeter = C ∆T
q = jumlah kalor
m = massa air (larutan) di dalam kalorimeter
c = kalor jenis air (larutan) di dalam kalorimeter
C = kapasitas kalor dari kalorimeter
∆T = kenaikan suhu larutan (kalorimeter)
Oleh karena tidak ada kalor yang terbuang ke lingkungan, maka kalor reaksi sama dengan kalor yang diserap oleh larutan dan kalorimeter, tetapi tandanya berbeda :
qreaksi = -(qlarutan + qkalorimeter)
Kalorimeter yang sering digunakan adalah kalorimeter bom. Kalorimeter bom terdiri dari sebuah bom (wadah tempatberlangsungnya reaksi pembakaran, biasanya terbuat dari berlangsungnya reaksi pembakaran, biasanya terbuat dari bahan stainless steel) dan sejumlah air yang dibatasi dengan wadah kedap panas. Jadi kalor reaksi sama dengan kalor yang diserap atau dilepaskan larutan, sedangkan kalor yang diserap atau dilepaskan larutan, sedangkan kalor yang diserap oleh gelas dan lingkungan diabaikan.
qreaksi = -qlarutan
Penentuan ∆H Reaksi dengan Hukum Hess
Hukum Hess : ” Kalor reaksi yang dilepas atau diserap hanya bergantung pada keadaan awal dan keadaan akhir”. Untuk mengubah zat A menjadi zat B (produk) diperlukan kalor reaksi sebesar ∆H. Atau cara lain yaitu mengubah zat A menjadi zat B dengan kalor reaksi ∆H1, zat B diubah menjadi zat C dengan kalor reaksi ∆H2 dan zat C diubah menjadi zat D dengan kalor reaksi ∆H3 . Sehingga harga perubahan entalpi adalah
∆Hreaksi = ∆H1 + ∆H2 + ∆H3 .
Hal tersebut dapat dibuat siklus dan diagram tingkat energinya sebagai berikut :
Siklus energi pembentukan zat D dari zat A
Diagram tingkat energi pembentukan zat D dari zat A
Contoh Soal :
Diketahui data entalpi reaksi sebagai berikut :
Ca(s) + ½ O2(g) → CaO(s) ∆H = - 635,5 kJ
C(s) + O2(g) → CO2(g) ∆H = - 393,5 kJ
Ca(s) + C(s) + ½ O2(g) → CaCO3(g) ∆H = - 1207,1 kJ
Hitunglah perubahan entalpi reaksi : CaO(s) + CO2(g) → CaCO3(s) !
Penyelesaian :
CaO(s) .............................→ Ca(s) +
½ O2(g) ....∆H = + 635,5 kJ
CO2(g)............................ → C(s) +
O2(g) ............∆H = + 393,5 kJ
Ca(s) + C(s) + ½ O2(g) → CaCO3(s).................
∆H = - 1207,1 kJ
_________________________________________ _
CaO(s) + CO2(g) ...........→ CaCO3(s).................. ∆H = - 178,1 kJ
Penentuan ∆H Reaksi Berdasarkan Data Perubahan
Entalpi
Pembentukan Standar ( ∆Hof ) Cara lain perhitungan entalpi reaksi yaitu berdasarkan entalpi pembentukan
standar( ∆Hof ) zat-zat yang ada pada reaksi tersebut.
1. ∆Hreaksi = ∑∆Hof produk - ∑∆Hof reaktan
2. TABEL ENTALPI PEMBENTUKAN BEBERAPA ZAT
|
Zat |
DHof ( kJ/mol ) |
Zat |
DHof ( kJ/mol ) |
|
H2(g) |
0 |
C2H4(g) |
+ 52,5 |
|
O2(g) |
0 |
CCl4(g) |
- 96,0 |
|
C(s) |
0 |
NH3(g) |
- 45,9 |
|
H2O(g) |
- 241,8 |
NO2(g) |
+ 33,2 |
|
H2O(l) |
- 285,8 |
SO2(g) |
- 296,8 |
|
CO2(g) |
- 393,5 |
HCl(g) |
- 92,3 |
|
CO(g) |
-110,5 |
NO(g) |
+ 90,3 |
Contoh Soal :
Dari tabel entalpi pembentukan diatas, tentukan :
a. ∆H reaksi pembakaran C2H4 !
b. Tentukan jumlah kalor yang dibebaskan pada pembakaran 56 g gas C2H4
a. Reaksi pembakaran C2H4
C2H4(g) + 3 O2(g)→2CO2(g) + 2H2O(l)
∆H reaksi = ∆Hof hasil reaksi - ∆Hof pereaksi
= ( 2. ∆Hof CO2 + 2. .∆Hof H2O ) – ( 1. ∆HofC2H4 + 3. ∆Hof O2)
= ( 2 . -393,5 + 2. -285,8 ) – ( 1. 52,5 + 3. 0 )
= -787 – 571,6 + 52,5
= - 1306,1 kJ/mol
b. Mr C2H4 = (2x12) + (4x1) = 28
Mol C2H4 = 56/28 = 2 mol
∆H pembakaran 2 mol C2H4 = 2 mol x ( -1306,1 kJ/mol ) = -2612,2 kJ
Jadi pada pembakaran 56 gram gas C2H4 dibebaskan kalor sebesar 2612,2 kJ
Penentuan ∆H Reaksi Dari Energi Ikatan
Reaksi kimia antarmolekul dapat dianggap berlangsung dalam 2 tahap yaitu :
I. Pemutusan ikatan pada pereaksi
II.Pembentukan ikatan pada produk
Misal, pada reaksi antara gas klorin dengan gas hidrogen membentuk gas hidrogen klorida dapat digambarkan sebagai berikut :
Sesuai dengan hukum Hess, ∆H reaksi total adalah ∆H
tahap-I + ∆H tahap-II.
∆H tahap-I = ∑ Energi ikatan pada pereaksi (yang putus)
∆H tahap-II = -∑ Energi ikatan pada produk (yang terbentuk).
∆H reaksi = ∑ Energi ikatan pereaksi yang putus - ∑ Energi ikatan produk yang
terbentuk
= ∑ Eruas kiri - ∑ Eruas kanan
TABEL ENERGI IKATAN
|
Ikatan |
E (kJ/mol) |
Ikatan |
E (kJ/mol) |
|
H-H |
436 |
O=O |
498 |
|
H-C |
415 |
C≡N |
891 |
|
H-N |
390 |
F-F |
160 |
|
C-C |
345 |
Cl-Cl |
243 |
|
C≡C |
837 |
H-Cl |
432 |
|
C-O |
350 |
C=C |
611 |
|
C=O |
741 |
I-I |
150 |
|
C-Cl |
330 |
N=N |
418 |
|
O-H |
450 |
C-F |
485 |
Penyelesaian :
........H
.........l
H – C – O-H +1 ½ O=O → O=C=O +2H-O-H
........l
.......H
∆H reaksi = ∑Epemutusan -∑Epembentukan
= { (3.Ec-H)+( 1.EO-H) +(1.EC-O)+ (1 ½ EO=O)} – {(2.EC=O) +(4.EO-H)}
= {(3.415)+(1.460)+(1.350)+1 ½.498)} –{(2.741)+(4.460)}
= 2802-3322
= -520 kJ/mol