Belajar Kimia - Prinsipdasar Atom dapat dibelokkan dalam sebuah medan magnet (dengan anggapan atom tersebut diubah menjadi ion terlebih dahulu). Karena partikel-partikel bermuatan listrik dibelokkan dalam medan magnet dan partikel-partikel yang tidak bermuatan (netral) tidak dibelokkan
Tahap pertama : Ionisasi
Atom diionisasi dengan mengambil satu atau lebih elektron dari atom tersebut supaya terbentuk ion positif. Ini juga berlaku untuk unsur-unsur yang biasanya membentuk ion-ion negatif (sebagai contoh, klor) atau unsur-unsur yang tidak pernah membentuk ion (sebagai contoh, argon).
Spektrometer massa ini selalu bekerja hanya dengan ion
positif.
Tahap kedua : Percepatan
Ion-ion tersebut dipercepat supaya semuanya mempunyai energi kinetik yang sama.
Tahap ketiga : Pembelokan
Ion-ion tersebut dibelokkan dengan menggunakan medan magnet, pembelokan yang terjadi tergantung pada massa ion tersebut. Semakin ringan massanya, akan semakin mudah dibelokkan. Besarnya pembelokannya juga tergantung pada besar muatan positif ion tersebut.
Semakin banyak elektron yang diambil pada tahap 1, semakin besar muatan ion tersebut, pembelokan yang terjadi akan semakin besar.
Tahap keempat : Pendeteksian
Sinar-sinar ion yang melintas dalam mesin tersebut dideteksi dengan secara elektrik.
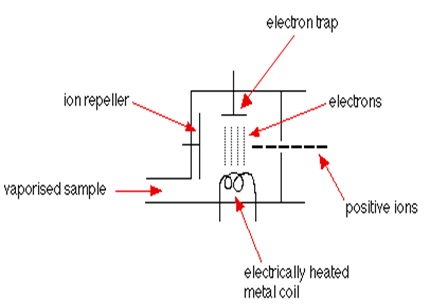
Ionisasi
Ø Sampel yang berbentuk gas (vaporised sample) masuk ke dalam ruang ionisasi. Kumparan metal yang dipanaskan dengan menggunakan listrik melepaskan elektron-elektron yang ada pada sampel dan elektron-elektron lepas itu menempel pada perangkap elektron (electron trap) yang mempunyai muatan positif.
Ø Partikel-partikel dalam sample tersebut (atom atau molekul) dihantam oleh banyak sekali elektron-elektron, dan beberapa dari tumbukan tersebut mempunyai energi cukup untuk melepaskan satu atau lebih elektron dari sample tersebut sehingga sample tersebut menjadi ion positif.
Ø Kebanyakan ion-ion positif yang terbentuk itu mempunyai muatan +1 karena akan jauh lebih sulit untuk memindahkan elektron lagi dari sample yang sudah menjadi ion positif.
Ø Ion-ion positif yang terbentuk masuk ke mesin yang merupakan sebuah lempengan metal yang bermuatan positif (Ion repeller).
Percepatan
Ion-ion positif yang ditolak dari ruang ionisasi yang sangat positif itu akan melewati 3 celah, dimana celah terakhir itu bermuatan 0 V. Celah yang berada di tengah mempunyai voltase menengah. Semua ion-ion tersebut dipercepat sampai menjadi sinar yang sangat terfokus.
Pembelokan
Besarnya pembelokan yang dialami oleh sebuah ion tergantung pada:
- Massa ion tersebut.
Ion-ion yang bermassa ringan akan
dibelokkan > ion-ion yang bermassa
berat.
- Muatan ion.
Ion yang mempunyai muatan +2 (atau lebih) akan dibelokkan > ion-ion yang bermuatan +1.
Dua faktor diatas digabungkan ke dalam Perbandingan Massa/Muatan Þ simbol m/z (atau m/e)
Pendeteksian
Pada gambar diatas, hanya sinar B yang bisa terus melaju sampai ke pendetektor ion. Ion-ion lainnya bertubrukan dengan dinding dimana ion-ion akan menerima elektron dan dinetralisasi.
Pada akhirnya, ion-ion yang telah menjadi netral tersebut akan dipisahkan dari spektrometer massa oleh pompa vakum.
Aliran elektron di dalam kabel itu dideteksi sebagai arus listrik yang bisa diperkuat dan dicatat. Semakin banyak ion yang datang, semakin besat arus listrik yang timbul.
Ketika sebuah ion menubruk kotak logam, maka ion tersebut akan dinetralisasi oleh elektron yang pindah dari logam ke ion. Hal ini akan menimbulkan ruang antara elektron-elektron yang ada dalam logam tersebut, dan elektron-elektron yang berada dalam kabel akan mengisi ruang tersebut.
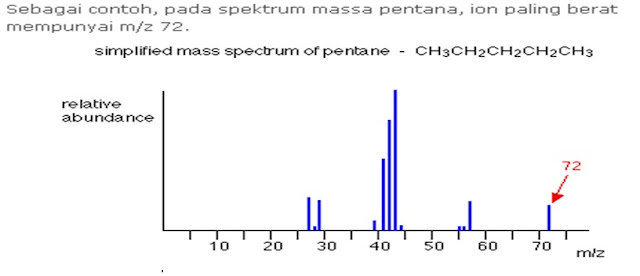
Puncak Ion Molekuler (M+)
Sampel organik yang teruapkan melewati kamar ionisasi
spektrometer massa, uap akan ditembak oleh berkas elektron. Elektron-elektron
ini mempunyai energi yang cukup untuk mengeluarkan sebuah elektron dari molekul
organik untuk membentuk ion positif disebut ion molekuler Þ M+ atau
Pada spektrum massa, ion paling berat (ion dengan nilai m/z paling
besar) akan dianggap sebagai ion molekuler.
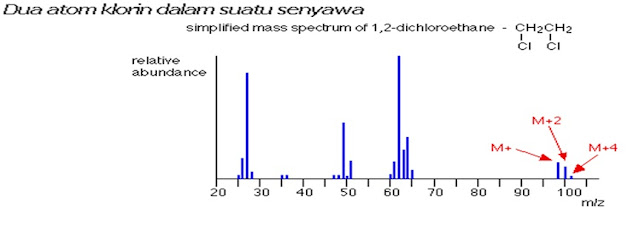
Spektra Massa – Puncak M+2
Puncak ion molekuler (M+ dan M+2) masing-masing mengandung satu atom klorin – tetapi klorin dapat berupa dua isotop klorin, 35Cl dan 37Cl.
Ion molekuler yang mengandung isotop 35Cl mempunyai massa rumus relatif 78. Sedangkan yang mengandung 37Cl mempunyai massa rumus relatif 80 – oleh karena itu ada dua garis pada m/z = 78 dan m/z = 80.
Perhatikan bahwa perbandingan tinggi puncaknya 3 : 1. Hal itu menunjukkan fakta bahwa klorin mengandung isotop 35Cl 3 kali lebih banyak daripada isotop 37Cl. Itu artinya bahwa akan ada 3 kali lebih banyak molekul yang mengandung isotop yang lebih ringan daripada yang lebih berat.
Garis-garis pada daerah ion molekuler (pada m/z 98, 100, dan 102) muncul karena adanya berbagai kombinasi isotop klorin yang mungkin. Karbon dan hidrogen menambah 28 – jadi berbagai ion molekuler yang mungkin adalah:
28 + 35 + 35 = 98
28 + 35 + 37 = 100
28 + 37 + 37 = 102
3 garis pada daerah ion molekuler ( M+, M+2, dan M+4)
dengan jarak masing-masing 2 unit m/z, dan dengan perbandingan tinggi puncak
9:6:1, maka senyawa tersebut mengandung 2 atom klorin.
Senyawa yang mengandung atom bromin
Bromin mempunyai dua isotop, 79Br dan 81Br dengan perkiraan perbandingan 1 : 1 (50,5 : 49,5 jika anda ingin lebih rumit!). Itu artinya bahwa suatu senyawa yang mengandung 1 atom bromin akan mempunyai dua puncak dalam daerah ion molekuler, tergantung pada isotop bromin mana yang terdapat pada ion molekuler.
Tidak seperti senyawa yang mengandung klorin, di sini dua puncak akan mempunyai tinggi yang hampir sama.
Karbon dan hidrogen akan menambah 29. Oleh karena itu nilai m/z puncak M+ dan M+2 adalah:
29 + 79 = 108
29 + 81 = 110