Belajar Kimia-Alkohol memang dapat diperoleh dari reaksi reduksi, tapi juga dapat bereaksi menggunakan reaksi oksidasi. Hasil dari sebuah proses reaksi oksidasi alkohol
tergantung pada alkohol apa yang digunakan apakah itu alkohol primer, sekunder
atau tersier. Yang pertama kita akan membandingkan reaksi oksidasi alkohol
primer.
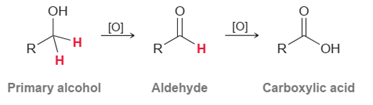 |
Perhatikan bahwa alkohol primer
memiliki dua proton pada posisi α (atom
karbon yang mengandung gugus hidroksil). Akibatnya, alkohol primer dapat
dioksidasi dua kali. Oksidasi pertama menghasilkan aldehida, dan kemudian
oksidasi aldehida menghasilkan asam karboksilat.
Alkohol sekunder hanya memiliki satu
proton pada posisi α sehingga hanya dapat dioksidasi
sekali, membentuk keton.
 |
Secara umum, keton tidak teroksidasi lebih
lanjut. Alkohol tersier tidak memiliki proton pada posisi α,
dan akibatnya, mereka umumnya tidak mengalami oksidasi:
 |
Sejumlah besar reagen tersedia untuk mengoksidasi
alkohol primer dan sekunder. Reagen pengoksidasi yang paling umum adalah asam
kromat (H2CrO4), yang dapat dibentuk dari chromium
trioxide (CrO3) atau dari sodium dichromate (Na2Cr2O7)
dalam larutan asam berair.
 |
Mekanisme oksidasi dengan asam kromat memiliki
dua langkah utama. Langkah pertama melibatkan pembentukan ester kromat, dan
langkah kedua adalah proses E2 untuk membentuk sebuah ikatan karbon-oksigen π
(bukan ikatan karbon-karbon π).
Berikut mekanisme oksidasi alkohol dengan asam kromat:
 |
Ketika alkohol primer dioksidasi dengan asam
kromat, asam karboksilat diperoleh. Secara umum sulit mengendalikan reaksi
untuk menghasilkan aldehida.
 |
Untuk menghasilkan aldehida sebagai produk akhir,
perlu menggunakan reagen pengoksidasi yang lebih selektif, yang akan bereaksi
dengan alkohol tetapi tidak akan bereaksi dengan aldehida. Banyak seperti itu
reagen tersedia, termasuk pyridinium chlorochromate (PCC). PCC terbentuk dari
reaksi antara piridin, kromium trioksida, dan asam klorida.





