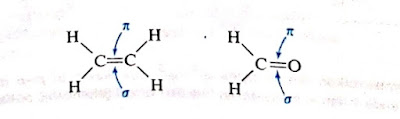
Belajar Kimia-Setiap orbital p yang berkontribusi pada ikatan pi mempunyai dua cuping dan mempunyai simpul pada inti. Tak mengherankan bahwa orbital pi dengan demikian juga bercuping dua dan mempunyai simpul. Tidak seperti orbital sigma, orbital pi tak simetrik silindrik namun demikian, seperti setiap orbital molekul lain, orbital pi dapat memegang maksimum dua pasang elektron.
Suatu orbital 2p dari karbon mempunyai energi agak lebih tinggi dari orbital sp. Dengan alasan ini, suatu ikatan pi, yang terbentuk dari dua orbital 2p, mempunyai energi agak lebih tinggi dan agak kurang stabil daripada ikatan sigma sp2-sp2. Energi disosiasi ikatan dari ikatan sigma suatu ikatan rangkap dua karbon-karbon dalam etilena diperkirakan sebesar 95 kkal/mol, sedangkan ikatan pi diperkirakan hanya 68 kkal/mol.
Elektron pi yang lebih tersingkap keluar lebih mudah dipengaruhi efek luar daripada elektron dalam ikatan sigma. Ikatan pi terpolarisasi lebih mudah-dapat dikatakan bahwa elektron pi lebih mobil. Elektron pi lebih mudah ditingkatkan ke orbital yang berenergi lebih tinggi (orbital anti-ikatan). Juga, mereka lebih mudah diserang oleh atom atau molekul luar. Apa arti sifat mudah diserang ini dari segi kimia senyawa berikatan pi? Dalam suatu molekul, ikatan pi merupakan kedudukan kereaktifan kimia.
Sifat lain dari ikatan pi adalah bahwa geometrinya menyebabkan molekul mempunyai bentuk yang kaku. Untuk atom karbon agar dapat berotasi sekeliling ikatannya, ikatan pi harus dipecah dahulu Seperti yang di tunjukan pada gambar dibawah ini. Dalam reaksi kimia, molekul dapat mempunyai cukup energi (kira-kira 68 kkal/mol) untuk memecahkan ikatan ini. Namun dalam labu pada suhu kamar, molekul tak mempunyai cukup energi agar pemecahan ikatan ini dapat ter jadi. (Kira-kira hanya ada 20 kkal/mol energi maksimum yang tersedia bagi molekul pada suhu kamar).
Dalam rumus struktur, ikatan rangkap dinyatakan oleh dua garis identik. Perhatikan bahwa ikatan rangkap bukan dua ikatan identik yang sederhana, tetapi bahwa garis rangkap menggambarkan satu ikatan sigma yang kuat dan satu ikatan pi yang lemah.
Sumber buku Kimia Organik Fessenden & Fessenden Edisi Ketiga