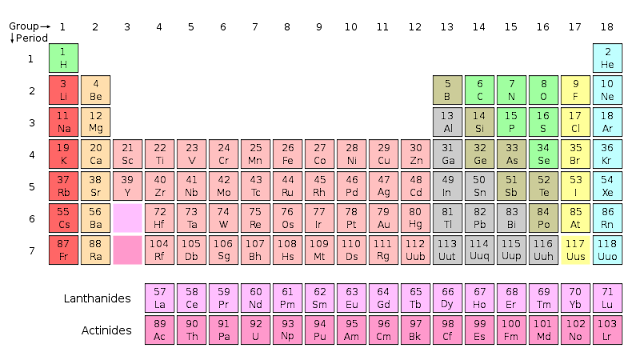
Belajar Kimia kali ini akan mencoba sedikit mengulas sistem periodik unsur. Ok kita mulai dari Perkembangan
Periodik Unsur.
1.
Berdasarkan Sifat Logam dan Non Logam
Unsur-unsur yang ada di alam dikelompokkan ke dalam 2 kelompok yaitu logam dan non logam. Pengelompokan ini merupakan metode paling sederhana , dilakukan dengan cara mengamati
ciri-ciri fisiknya
2. Berdasarkan Hukum Triade Dobereiner
Tahun 1817 Dobereiner menemukan adanya beberapa kelompok tiga unsur yang memiliki kemiripan sifat, yang ada hubungannya dengan massa atom. Kelompok ini dinamakan triade. Berdasarkan eksperimennya disimpulkan bahwa berat atom unsur kedua hampir sama atau mendekati berat rata-rata dari unsur sebelum dan
sesudahnya.
Pengelompokkan unsur dari Dobereiner dapat digambarkan sebagai berikut:
Unsur-unsur yang ada di alam dikelompokkan ke dalam 2 kelompok yaitu logam dan non logam. Pengelompokan ini merupakan metode paling sederhana , dilakukan dengan cara mengamati
ciri-ciri fisiknya
2. Berdasarkan Hukum Triade Dobereiner
Tahun 1817 Dobereiner menemukan adanya beberapa kelompok tiga unsur yang memiliki kemiripan sifat, yang ada hubungannya dengan massa atom. Kelompok ini dinamakan triade. Berdasarkan eksperimennya disimpulkan bahwa berat atom unsur kedua hampir sama atau mendekati berat rata-rata dari unsur sebelum dan
sesudahnya.
Pengelompokkan unsur dari Dobereiner dapat digambarkan sebagai berikut:
3. Hukum Oktaf dari Newland
Unsur-unsur dikelompokkan berdasarkan kenaikan massa atom relatifnya (Ar).
Unsur ke-8 memiliki sifat kimia mirip dengan unsur pertama; unsur ke-9 memiliki sifat yang mirip dengan unsur ke-2 dst. Sifat-sifat unsur yang ditemukan berkala atau periodik setelah 8 unsur disebut Hukum Oktaf.
Unsur
H sifatnya sama dengan unsur F,unsur Li sifatnya sama dengan unsur Na dan
seterusnya
3.Berdasarkan Periodik Mendeleev
Lothar Meyer lebih mengutamakan sifat-sifat kimia unsur sedangkan Mendeleev lebih
mengutamakan kenaikan massa atom.
Menurut Mendeleev : sifat-sifat unsur adalah fungsi periodik dari massa atom
relatifnya. Artinya : jika unsur-unsur disusun menurut kenaikan massa atom relatifnya, maka
Sifat tertentu akan berulang secara periodik.
4.Sistem Periodik Modern (Sistem Periodik Panjang)
Dikemukakan oleh Henry G Moseley, yang berpendapat bahwa sifat-sifat fisis dan kimia unsur merupakan fungsi periodik dari nomor atomnya .Artinya : sifat dasar suatu unsur ditentukan oleh nomor atomnya bukan oleh massa atom relatifnya (Ar).
Pengelompokkan ini dikenal dengan sistem periodik panjang yang diketahui dengan nama Sistem Periodik Modern. Sistem ini terdiri dari 2 hal yaitu golongan (lajur vertikal) dan periode(lajur horisontal)
3.Berdasarkan Periodik Mendeleev
Lothar Meyer lebih mengutamakan sifat-sifat kimia unsur sedangkan Mendeleev lebih
mengutamakan kenaikan massa atom.
Menurut Mendeleev : sifat-sifat unsur adalah fungsi periodik dari massa atom
relatifnya. Artinya : jika unsur-unsur disusun menurut kenaikan massa atom relatifnya, maka
Sifat tertentu akan berulang secara periodik.
4.Sistem Periodik Modern (Sistem Periodik Panjang)
Dikemukakan oleh Henry G Moseley, yang berpendapat bahwa sifat-sifat fisis dan kimia unsur merupakan fungsi periodik dari nomor atomnya .Artinya : sifat dasar suatu unsur ditentukan oleh nomor atomnya bukan oleh massa atom relatifnya (Ar).
Pengelompokkan ini dikenal dengan sistem periodik panjang yang diketahui dengan nama Sistem Periodik Modern. Sistem ini terdiri dari 2 hal yaitu golongan (lajur vertikal) dan periode(lajur horisontal)
Golongan dan Periode Unsur-Unsur
dalam Tabel Periodik
1. Golongan
Golongan adalah lajur tegak pada Tabel Peiodik Unsur. Unsur-unsur yang ada dalam satu lajur tegak adalah unsur-unsur segolongan, terdapat 8 golongan utama dan 8 golongan transisi.
1. Golongan
Golongan adalah lajur tegak pada Tabel Peiodik Unsur. Unsur-unsur yang ada dalam satu lajur tegak adalah unsur-unsur segolongan, terdapat 8 golongan utama dan 8 golongan transisi.
Golongan utama tersebut adalah:
a. Golongan I A (alkali) terdiri dari unsur-unsur H, Li, Na, K, Rb,Cs,Fr
b. Golongan II A (alkali tanah) terdiri dari unsur-unsur Be, Mg, K,Sr,Ba,Ra
c. Golongan III A ( aluminum) terdiri dari unsur-unsur B,Al,Ga,In,Tl
d. Golongan IV A (karbon) terdiri dariunsur-unsur C,Si,Ge,Sn,Pb
e. Golongan V A (nitrogen) terdiri dari unsur-unsur N,P,As,Sb,Bi
f. Golongan VI A (oksigen) terdiri dari unsur-unsur O,S,Se,Te,Po
g. Golongan VII A (halogen) terdiri dari unsur-unsur F,Cl,Br,I,At
h. Golongan VIII A (gas mulia) terdiri dari unsur-unsur He,Ne,Ar,Kr,Xe,Rn
2. Periode
Perioda adalah lajur horisontal dalam sistem periodik modern terdiri dari 7 periode
a. Periode 1 (periode sangat pendek) berisi 2 unsur
b. Periode 2 (periode pendek) berisi 8 unsur
c. Periode 3 (periode pendek) berisi 8 unsur
d. Periode 4(periode panjang) berisi 18 unsur
e. Periode 5 (periode panjang) berisi 18 unsur
f. Periode 6 (periode sangat panjang ) berisi 32 unsur
g. Periode 7 (periode sangat panjang) berisi 28 unsur,belum lengkap karena maksimum 32 unsur
a. Golongan I A (alkali) terdiri dari unsur-unsur H, Li, Na, K, Rb,Cs,Fr
b. Golongan II A (alkali tanah) terdiri dari unsur-unsur Be, Mg, K,Sr,Ba,Ra
c. Golongan III A ( aluminum) terdiri dari unsur-unsur B,Al,Ga,In,Tl
d. Golongan IV A (karbon) terdiri dariunsur-unsur C,Si,Ge,Sn,Pb
e. Golongan V A (nitrogen) terdiri dari unsur-unsur N,P,As,Sb,Bi
f. Golongan VI A (oksigen) terdiri dari unsur-unsur O,S,Se,Te,Po
g. Golongan VII A (halogen) terdiri dari unsur-unsur F,Cl,Br,I,At
h. Golongan VIII A (gas mulia) terdiri dari unsur-unsur He,Ne,Ar,Kr,Xe,Rn
2. Periode
Perioda adalah lajur horisontal dalam sistem periodik modern terdiri dari 7 periode
a. Periode 1 (periode sangat pendek) berisi 2 unsur
b. Periode 2 (periode pendek) berisi 8 unsur
c. Periode 3 (periode pendek) berisi 8 unsur
d. Periode 4(periode panjang) berisi 18 unsur
e. Periode 5 (periode panjang) berisi 18 unsur
f. Periode 6 (periode sangat panjang ) berisi 32 unsur
g. Periode 7 (periode sangat panjang) berisi 28 unsur,belum lengkap karena maksimum 32 unsur
Sistem
periodik modern (SPU) disusun berdasarkan kenaikan nomor atom (lajur horizontal
atau periode) dan kemiripan sifat (lajur vertikal atau golongan).
Sistem periodik modern terdiri atas 7 periode dan 8 golongan. Berdasarkan golongannya, unsur-unsur SPU dibedakan menjadi:
Sistem periodik modern terdiri atas 7 periode dan 8 golongan. Berdasarkan golongannya, unsur-unsur SPU dibedakan menjadi:
a.
Golongan utama (Golongan A)
b. Golongan transisi (Golongan B)
b. Golongan transisi (Golongan B)
Berdasarkan
jenis orbital yang ditempati oleh elektron terakhir, unsur-unsur dalam sistem
periodik dibagi atas blok s, blok p, blok d, dan blok f.
a. Blok
s: golongan I A dan II A. Blok s tergolong logam aktif, kecuali H (nonlogam)
dan He (gas mulia).
b. Blok p: golongan III A sampai dengan VIII A. Blok p disebut juga unsur wakil karena terdapat semua jenis unsur (logam, nonlogam, dan metaloid).
c. Blok d: golongan III B sampai II B. Unsur blok d disebut juga unsur transisi, semuanya
tergolong logam.
d. Blok f: unsur blok f ini disebut juga unsur transisi dalam, semuanya terletak pada golongan IIIB, periode 6 dan 7.
1) Periode 6 dikenal sebagai deret lantanida (4f).
2) Periode 7 dikenal sebagai deret aktinida (5f)
Hubungan Konfigurasi Elektron dengan Sistem Periodik
Hubungan antara letak unsur dalam sistem periodik dengan konfigurasi elektronnya
adalah sebagai berikut.
1. Nomor periode sama dengan jumlah kulit
2. Nomor golongan sama dengan jumlah elektron valensi
Contoh soal:
Tentukan golongan dan periode dari unsur !
Jawab:
mempunyai nomor atom 35 sehingga konfigurasi elektronnya X = 2.8.18.7
Elektron valensi= 7 ► Golongan VII A, jumlah kulit 4►periode 4
b. Blok p: golongan III A sampai dengan VIII A. Blok p disebut juga unsur wakil karena terdapat semua jenis unsur (logam, nonlogam, dan metaloid).
c. Blok d: golongan III B sampai II B. Unsur blok d disebut juga unsur transisi, semuanya
tergolong logam.
d. Blok f: unsur blok f ini disebut juga unsur transisi dalam, semuanya terletak pada golongan IIIB, periode 6 dan 7.
1) Periode 6 dikenal sebagai deret lantanida (4f).
2) Periode 7 dikenal sebagai deret aktinida (5f)
Hubungan Konfigurasi Elektron dengan Sistem Periodik
Hubungan antara letak unsur dalam sistem periodik dengan konfigurasi elektronnya
adalah sebagai berikut.
1. Nomor periode sama dengan jumlah kulit
2. Nomor golongan sama dengan jumlah elektron valensi
Contoh soal:
Tentukan golongan dan periode dari unsur !
Jawab:
mempunyai nomor atom 35 sehingga konfigurasi elektronnya X = 2.8.18.7
Elektron valensi= 7 ► Golongan VII A, jumlah kulit 4►periode 4