Belajar kimia akan melanjutkan kembali pembahasan mengenai radiasi elektromagnetik. Yuk kita mulai.
Dalam spektroskopi infra merah, frekuensi dinyatakan dalam bilangan gelombang dengan banyaknya daur persentimeter. Satuan bialngan gelombang adalah persentimeter 1/cm atau cm-1. Satuan yang digunakan untuk panjang gelombang dalam spektroskopi infrmaerah adalah mikrometer.
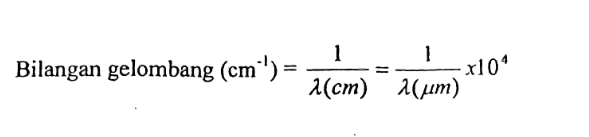 |
Radiasi elektromagentik dipancarkan dalam bentuk paket-paket energi yang mempunyai partikel yang disebut foton atau kuantum. Energi suatu poton berbanding terbalik dengan panjang gelombangnya.
 |
Radiasi dengan panjang gelombangblebih pendek mempunyai energi lebih tinggi, oleh karena itu sebuah foton cahaya ultraviolet berenergi lebih tinggi daripada sebuah foton cahaya tampak dan jauh lebih tinggi dari pada sebuah foton gelombang radio.
 |
Sebaliknya energi sebuah foton suatu radiasi elektromagnetik berbanding lurus dengan frekuensinya. Hubungan ini dirumuskan dengan persamaan E=hv.
Molekul hanya menyerap radiasi elektromagnetik dengan panjang gelombang yang khusus. Absorbsi cahaya ultraviolet mengakibatkan pindahnya elektron ke orbital dengan energi yang lebih tinggi. Radiasi inframerah tidak cukup mengandung energi untuk mempromosikan elektron semacam itu. Absorbsi radiasi inframerah hanya mengakibatkan membesarnya amplitudo getaran atom-atom yang terikat satu sama lain. Bila suatu contoh senyawa menyerap foton-foton radiasi maka banyaknya foton yang berhasil melewati senyawa organik itu akan lebih rendah daripada yang mula-mula memasuki senyawa organik. Absorbsi ini akan diamati sebagai menurunnya intensitas radiasi. Perubahan intensitas inilah yang digunakan sebagai suatu pengukuran dalam spektroskopi.
 |
| Simbol yang sering digunakan dalam spekteoskopi |





