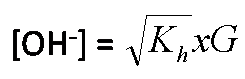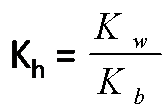Belajar
kimia kali ini akan mencoba mengulas sedikit terkait Hidrolisis Garam. Reaksi
asam dan basa menghasilkan garam. Asam terdiri dari asam kuat dan asam lemah.
Demikian juga basa, ada yang termasuk ke dalam basa kuat ada juga yang
merupakan basa lemah.
Beberapa contoh asam kuat:
H2SO4.......asam sulfat
HCl..........asam klorida
HBr.........asam bromida
HI..........asam Yodida
HNO3........asam nitrat
HClO3.......asam klorat
HClO4.......asam perklorat
H2SO4.......asam sulfat
HCl..........asam klorida
HBr.........asam bromida
HI..........asam Yodida
HNO3........asam nitrat
HClO3.......asam klorat
HClO4.......asam perklorat
Beberapa contoh basa kuat
Li(OH)2....lithium hidroksida
NaOH........natrium hidroksida
KOH..........kalium hidroksida
Ca(OH)2...kalsium hidroksida
Ba(OH)2...barium hidroksida
RbOH........rubidium hidroksida
Sr(OH)2...stronsium hidroksida
Sifat- sifat larutan garam
Li(OH)2....lithium hidroksida
NaOH........natrium hidroksida
KOH..........kalium hidroksida
Ca(OH)2...kalsium hidroksida
Ba(OH)2...barium hidroksida
RbOH........rubidium hidroksida
Sr(OH)2...stronsium hidroksida
Sifat- sifat larutan garam
Sifat-sifat larutan garam ada
3 macam yaitu :
1.
Larutan garam yang bersifat netral yaitu garam yang terbentuk dari asam kuat
dan basa kuat atau terbentuk dari asam lemah dan basa lemah. Contoh : NaCl , CH3COONH4
2.
Larutan garam yang bersifat asam yaitu garam yang terbentuk dari asam kuat dan
basa lemah. Contoh : NH4Cl, Al2(SO4)3
3.
Larutan garam yang bersifat basa yaitu garam yang terbentuk dari basa kuat dan
asam lemah. Contoh : CH3COONa, Na2CO3
4.
Larutan garam yang terbentuk dari asam lemah dan basa lemah dapat bersifat
asam, basa, netral
.Karena garam ini terhidrolisis sempurna, maka harga pH bukan tergantung pada
konsentrasi garamnya, tetapi bergantung pada harga Ka dan Kb-nya.
a.
Jika Ka = Kb ,larutan garam bersifat netral (pH=7)
b.
Jika Ka = Kb , larutan garam bersifat asam (pH<7 span="">
c.
Jika Ka = Kb , larutan garam bersifat basa (pH>7)
Garam
terdiri dari 4 jenis
1. Terbentuk dari asam kuat dan basa kuat ,bersifat netral contohnya NaCl,K2SO4
2. Terbentuk dari asam kuat dan basa lemah ,bersifat asam, contohnya NH4Cl dan
Al2(SO4)3
3. Terbentuk dari asam lemah dan basa kuat , bersifat basa, contohnya
CH3COONa,HCOOK,Na2CO3
4. Terbentuk dari asam lemah dan basa lemah, sifatnya tergantung harga Ka dan Kb, contohnya (NH4)2CO3
1. Terbentuk dari asam kuat dan basa kuat ,bersifat netral contohnya NaCl,K2SO4
2. Terbentuk dari asam kuat dan basa lemah ,bersifat asam, contohnya NH4Cl dan
Al2(SO4)3
3. Terbentuk dari asam lemah dan basa kuat , bersifat basa, contohnya
CH3COONa,HCOOK,Na2CO3
4. Terbentuk dari asam lemah dan basa lemah, sifatnya tergantung harga Ka dan Kb, contohnya (NH4)2CO3
pH
larutan garam
1. Garam yang berasal dari
Asam kuat dan Basa kuat tidak mengalami hidrolisis. pH = 7
2. Garam yang berasal dari
Asam lemah dan Basa kuat hanya mengalami hidrolisis sebagian dalam air.
Rumus :
4. Garam yang berasal dari
Asam lemah dan Basa lemah mengalami hidrolisis total dalam air.
Rumus :
LATIHAN
1. Tentukan pH dari :
a. larutan KCl 0,01 M
b. larutan Mg(NO3)2 0,2 M
c. larutan KNO3 0,5 M
2. Tentukan pH larutan NH4Cl 0,02 M ! (Kb = 1,8.10-5)
3. Untuk membuat larutan garam CH3COONa
dengan pH=10, hitung massa CH3COONa yang harus dilarutkan dalam 100 ml air ! (Mr=82, Ka=10-5).
Kunci Jawaban :
1. a. pH KCl 0,01 M = 7, karena KCl merupakan garam yang berasal dari
asam kuat dan basa lemah.
b. pH Mg(NO3)2 0,2 M = 7, karena Mg(NO3)2
merupakan garam yang berasal dari asam kuat dan basa kuat.
c. pH KNO3 0,5 M = 7, karena KNO3 merupakan garam
yang berasal dari asam kuat dan basa kuat.
2. NH4Cl(aq) -----> NH4+(aq)
+ Cl-(aq)
0,02 M........... 0,02 M
[H+] = 3,3 . 10 -6
pH
= -log 3,3 . 10-6
= 6
– log 3,3
3. pH
= 10
pOH
= 14-10 = 4
[OH-]
= 10-4
[G] = 10 M
n = 10 x0,1 = 1 mol
m CH3COONa = 1 x 82 = 82 gram