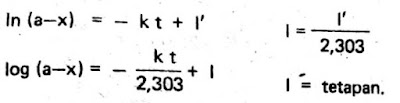Kecepatan reaksi dipelajari secara kuantitatif dari segi tingkat reaksi atau reaction order. Suatu reaksi disebut tingkat satu, bila kecepatannya berbanding lurus dengan salah satu konsentrasi pengikutnya. Reaksi disebut tingkat dua, bila kecepatan reaksi berbanding lurus dengan konsentrasi berpangkat dua pengikut atau satu pengikut berpangkat dua, Reaksi disebut tingkat tiga, bila kecepatan reaksinya berbanding lurus dengan konsentrasi tiga pengikut., satu pengikut pangkat dua dan satu pengikut pangkat satu atau satu pengikut pangkat tiga. Hanya sedikit dikenal reaksi yang bertingkat tiga, Reaksi disebut tingkat nol bila kecepatan reaksi tidak tergantung konsentrasi pengikut reaksi
Contoh reaksi tingkat satu
Contoh reaksi tingkat satu
 |
Kecepatan reaksi ini berbanding lurus dengan konsentrasi pengikutnya, bila faktor-faktor lain tetap. Secara matematis di tulis sebagai berikut:
dc adalah konsentrasi pereaksi dalam mol/l yang diubah selama dt. Tanda minus menyatakan, bahwa konsentrasi ber
kurang terhadap waktu, k disebut tetapan kecepatan reaksi jenis
Untuk reaksi umum
A-------> hasil
Integrasi persamaan ini memghasilkan:
Integrasi dengan batas-batas x=0 bila t=0 dan x=x bila t=t maka:
Reaksi tingkat satu selalu memenuhi persamaan diatas, untuk membuktikan apakah suatu reaksi tingkat satu dapat dibuktikan dengan langkah berikut:
1. Harga k untuk pasangan-pasangan t dan a dicari dengan rumus diatas, bila harga k tetap berarti reaksi tingkat satu, jika k berubah-ubah berarti reaksi tingkat lain.
2. Dari rumus berikut:
1. Harga k untuk pasangan-pasangan t dan a dicari dengan rumus diatas, bila harga k tetap berarti reaksi tingkat satu, jika k berubah-ubah berarti reaksi tingkat lain.
2. Dari rumus berikut:
Dapat diambil kesimpulan, bahwa apabila reaksi tingkat satu maka grafik log (a-x) terhadap t harus berupa garis lurus dan miringnya = -t/2.303
3. Reaksi tingkat satu juga dapat diselidiki dengan waktu setengah umur atau waktuh paroh. Waktu paroh merupakab waktu yabg diperlukan untuk bereaksinya separoh jumalah pereaksi. Kalau pada t=0, x=0 maka pada saat t=t1/2 maka x =1=2a
3. Reaksi tingkat satu juga dapat diselidiki dengan waktu setengah umur atau waktuh paroh. Waktu paroh merupakab waktu yabg diperlukan untuk bereaksinya separoh jumalah pereaksi. Kalau pada t=0, x=0 maka pada saat t=t1/2 maka x =1=2a
Ini berarti bahwa waktu paroh untuk reaksi tingkat satu tidak tergantung dari konsentrasi awal.
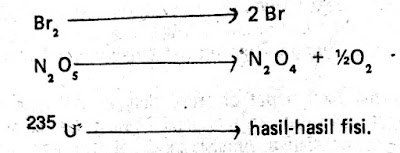
Berikut persamaan reaksi tingkat 1 yang homogen. Berikut reaksi homogen gas.
Berikut persamaan reaksi tingkat 1 yang homogen. Berikut reaksi homogen gas.
Reaksi homogen larutan.
Ada juga beberapa reaksi tingkaf satu biomolekuler artinya terjadi pada 2 molekul tetapi bertingkat satu seperti inversi sukrose dan hidrolisis etil asetat. Hal ini disebabkan karena jumlah air yang sangat banyak, sehingga konsentrasi tetap selama reaksi: