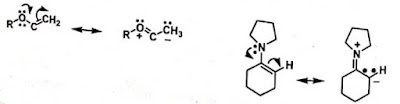Resonansi merupakan penempatan relatif elektron
non-ikatan dan elektro pi keseluruh cincin suatu senyawa tanpa merubah posisi
dari atom-atomnya. Penulisan struktur resonansi berguna dalam:
1. Memperkirakan stabilitas dari anion, kation atau
radikal.
2. Memperkirakan stabilitas relatif dari suatu
spesies yang tidak jauh berbeda stabilitasnya dan bisa memprediksi arah reaksi
yang disukai baik secara kinetik atau termodinamik (spesies yang paling stabil
mudah terbentuk)
3. Memperkirakan sisi aktif dari molekul
Beberapa hal yang berkaitan dengan struktur
resonansi adalah sebagai berikut:
1. Semakin banyak struktur resonansi yang dapat
digambarkan maka semakin stabil spesies tersebut.
2. Struktur resonansi dimana setiap atom mengikuti
kaidah delapan hukum oktet adalah stabil.
3. Struktur resonansi dimana muatan negatifnya
berada pada atom yang elektronegatif mempunyai kestabilan yang tinggi.
Sebaliknya struktur resonansi yang muatan positifnya berada pada atom yang
kurang elektronegatif adalah yang paling stabil.
4. Kestabilan maksimum dari spesies (anion atau
kation) akan dapat dicapai jika kontribusi struktur resonansinya adalah
ekuivalen mempunyai kesamaan energi. Seperti contoh dibawah ini:
Struktur resonansi melibatkan Anion
Dua struktur resonansi dapat ditulis untuk anion
karbosilat berikut:
Contoh 1
Struktur ini adalah ekuivalen artinya mempunyai
energi yang sama. Dengan atom hidrogen dari asam karboksilat (R-COOH) adalah
bersifat asam dan mudah diberikan ke basa.
Contoh 2
Struktur diatas merupakan non-ekuivalen, muatan
negatif berada pada dua atom yang berbeda (O dan C). Struktur resonansi dengan
muatan negatif pada atom yang lebih elektronegatif adalah lebih stabil
(F>O>N>Cl>C).
Contoh 3
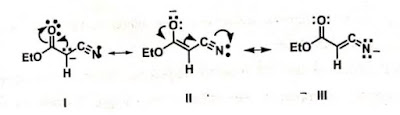
Tingkat kestabilan dari struktur resonansi I-III
pararel dengan tingkat elektronegatifitas dari tiga atom yang terikat dengan
muatan negatif. Jadi II>III>I (O>N>C).
Makin banyak delokalisasi muatan negatif, makin
besar kestabilan anion. Bila di bandingkan kestabulan dua anion, maka yang
paling banyak jumlah struktur resonansinya adalah yang paling stabil. Anion
yang distabilkan melalui resonansi mempunyai tingkat kestabilan yang tinggi dan
mudah di bentuk. Oleh karena itu, keasaman relatif dari asam Brosnted dientukan
oleh stabilitas dari anion yang berhubungan.
Contoh 4
Bila etil asetat diperlakukan dengan suatu basa
maka anion yang distabilkan melalui resonansi mudah terbentuk seperti gambar
berikut:
Struktur Resonansi yang Melibatkan
Kation
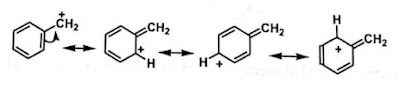
Karbokation allilik dan benzilik, sama seperti
karbokation yang mempunyai heteroatom berikatan langsung dengan Karbon yang
mempunyai muatan positif dan distabilkan melalui resonansi.
Contoh
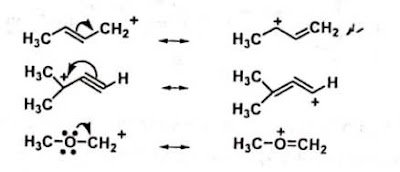
Vinil eter mempunyai resonansi kation yang
kira-kira sama dan distabilisasi oleh adanya asam.
Contoh kation vinilik
Contoh kation benzilik
Struktur Resonansi Melibatkan Molekul
Netral
Struktur A lebih stabil dari B, struktur B adalah
kobtributor signifikan yang diperhitungkan untuk:
1. Mengamati rotasi terbatas dari ikatan C-N dalam
ikatan amida dan peptida.
2. Mengamati penurunan kebasaan amida dibanding
amina (muncuk dari rendahnya keberadaan pasangan elektron non-ikatan pada
nitrogen dari amida)
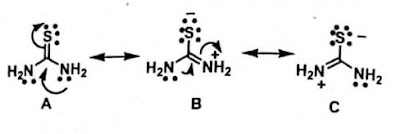
Pada Tiourea dan Tioamida reaksi SN2 muncul pada
atom S sebab adanya kontribusi dari struktur resonansi yang digambarkan dibawah
ini, dan tingginya kebasaan S.
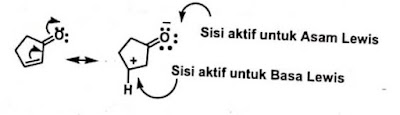
Struktur resonansi dapat digunakan untuk
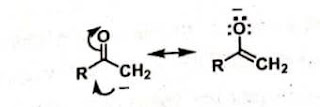
memprediksi sisi aktif dari molekul netral. Contoh, pada reaksi dari senyawa
keton alpha dan Beta tak jenuh dengan suatu basa lewis ( reaksi adisi michael)
bisa diprediksi melalui pertimbangan struktur resonansi berikut: struktur
resonansi ini secara jelas mengidentifikasikan bahwan karbon beta adalah
kekurangan elektron (asam lewis) dan dapat menerima pasangan elektron dari
nukleofil (basa lewis).
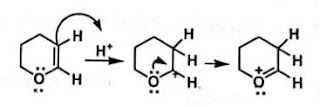
Struktur resonansi berikut memberikan gambaran
tentang sisi aktif daru vinil eter dan enamin serta memberi pemahaman yang baik
tentang sifat kimia dari senyawa kelas ini.