Surfaktan merupakan bahan aktif permukaan. Surfaktan ini memiliki gugus
hidrofilik dan gugus hidrofobik sehingga dapat mempersatukan campuran yang
terdiri dari air dan minyak. Aktifitas surfaktan diperoleh karena sifat ganda
dari molekulnya. Molekul surfaktan memiliki bagian polar yang suka akan air
(hidrofilik) dan bagian non polar yang suka akan minyak/lemak (hidrofobik).
Bagian polar molekul surfaktan dapat bermuatan positif, negatif atau netral.
Sifat rangkap ini yang menyebabkan surfaktan dapat diadsorbsi pada antar muka
udara-air, minyak-air dan zat padat-air, membentuk lapisan tunggal dimana gugus
hidrofilik berada pada fase air dan rantai hidrokarbon ke udara, dalam kontak
dengan zat padat ataupun terendam dalam fase minyak. Umumnya bagian non polar
(hidrofobik) adalah merupakan rantai alkil yang panjang ”ekor”, sementara
bagian yang polar (hidrofilik) mengandung gugus hidroksil dan nampak sebagai
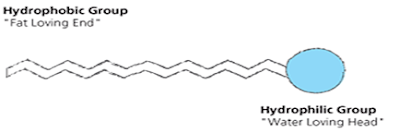
“kepala” surfaktan. Representasi surfaktan ditunjukan paga Gambar di bawah ini.
Gugus hidrofilik pada
surfaktan bersifat polar dan mudah bersenyawa dengan air, sedangkan gugus
hidrofobik bersifat non polar dan mudah bersenyawa dengan minyak. Pada suatu
molekul surfaktan, salah satu gugus harus lebih dominan jumlahnya.
Molekul-molekul surfaktan akan diadsorpsi lebih kuat oleh air dibandingkan
dengan minyak apabila gugus polarnya yang lebih dominan. Hal ini menyebabkan
tegangan permukaan air menjadi lebih rendah sehingga mudah menyebar dan menjadi
fase kontinyu. Sebaliknya, apabila gugus non polarnya lebih dominan, maka
molekul-molekul surfaktan tersebut akan diadsorpsi lebih kuat oleh minyak
dibandingkan dengan air. Akibatnya tegangan permukaan minyak menjadi lebih
rendah sehingga mudah menyebar dan menjadi fase kontinyu.
Penambahan surfaktan
dalam larutan akan menyebabkan turunnya tegangan permukaan larutan. Setelah
mencapai konsentrasi tertentu, tegangan permukaan akan konstan walaupun
konsentrasi surfaktan ditingkatkan. Bila surfaktan ditambahkan melebihi
konsentrasi ini maka surfaktan mengagregasi membentuk misel. Konsentrasi
terbentuknya misel ini disebut critical micelle concentration (cmc). Tegangan
permukaan akan menurun hingga cmc tercapai. Setelah cmc tercapai, tegangan permukaan
akan konstan yang menunjukkan bahwa antar muka menjadi jenuh dan terbentuk
misel yang berada dalam keseimbangan dinamis dengan monomernya.
Pada konsentrasi
kritik misel terjadi penggumpalan atau agregasi dari molekul-molekul surfaktan
membentuk misel. Misel biasanya terdiri dari 50 sampai 100 molekul asam lemak
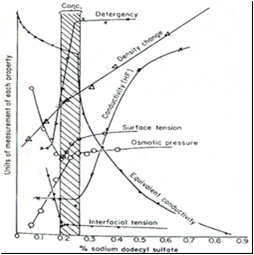
dari sabun Sifat-sifat koloid dari larutan elektrolit natrium dedosil sulfat
dapat dilihat pada Gambar berikut:
Ada beberapa faktor
yang mempengaruhi nilai cmc, untuk deret homolog surfaktan rantai hidrokarbon,
nilai cmc bertambah 2x dengan berkurangnya satu atom C dalam rantai. Gugus
aromatik dalam rantai hidrokarbon akan memperbesar nilai cmc dan juga
memperbesar kelarutan. Adanya garam menurunkan nilai cmc surfaktan ion.
Penurunan cmc hanya bergantung pada konsentrasi ion lawan, yaitu makin besar
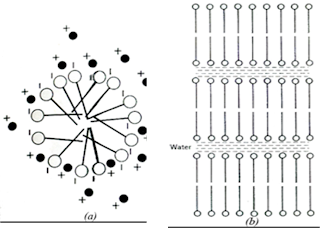
konsentrasinya makin turun cmc-nya.Secara umum misel dibedakan menjadi dua,
yaitu: struktur lamelar dan sterik seperti telihat pada Gambar berikut:
Karena pada cmc
terjadi penggumpalan dari molekul surfaktan, maka cara penentuan cmc dapat
menggunakan cara-cara penentuan besaran fisik yang menunjukkan perubahan dari
keadaan ideal menjadi tak ideal. Di bawah cmc larutan menjadi bersifat ideal.
Sedangkan diatasnya cmc larutan bersifat tak ideal. Besaran fisik yang dapat
digunakan ialah tekanan osmosa, titik beku larutan, hantaran jenis atau
hantaran ekivalen, kelarutan solubilisasi, indeks bias, hamburan cahaya,
tegangan permukaan, dan tegangan antarmuka.