Kurva
titrasi dibuat dengan menghitung pH campuran reaksi pada beberapa titik yang berbeda selama perubahan larutan basanya. Bentuk kurva titrasi
tergantung pada kekuatan asam dan basa yang direaksikan.
Reaksi antara 25 ml HCl 0,1 M
dengan NaOH 0,1 M, reaksi yang terjadi sebagai berikut :
HCl(aq) + NaOH(aq)
---->NaCl(aq) + H2O(aq)
 |
| Asam Kuat dengan Basa Kuat |
Kurva asam kuat dengan basa kuat dapat dilihat pada gambar diatas. pH
sebelum NaOH =1, Setelah penambahan 10 ml NaOH pH menjadi 1,37. Penambahan 25 ml NaOH pH
= 7, karena terjadi titik ekuivalen yang menyebabkan larutan garam NaCl
bersifat netral. Penambahan 26 ml NaOH berubah drastic menjadi 11,29. Garam
NaCl yang terbentuk dari asam kuat dan basa kuat yang merupakan elektrolit kuat
tidak akan terhidrolisis, karena larutannya bersifat netral
(pH=7).
Contoh : NaCl(aq) ----> Na+(aq) + Cl-(aq)
Na+(aq) +
H2O(l) ---->
Cl- (aq) + H2O(l)---->
b. Titrasi Asam Kuat dengan Basa Lemah
Reaksi antara 25 ml HCl 0,1 M dengan NH3 0,1 M (Kb
= 10-5). Reaksinya sebagai berikut :
HCl(aq) + NH3(aq) ---->NH4Cl(aq)
Sebelum penambahan NH3, pH =1, setelah penambahan 10 ml NH3,
pH =1,37, penambahan 25 ml NH3, pH=5,15 yang merupakan titik ekuivalen.
Penambahan 26 ml NH3, pH berubah sedikit, yaitu 6,1.Penambahan sedikit basa maka pH garam hamper tidak berubah, sehingga
merupakan larutan penyangga. Titik ekuivalen terjadi pada pH<7>karena
garam yang terbentuk mengalami hidrolisis sebagian yang bersifat asam.
NH4Cl(aq) ---> NH4(aq) + Cl-
NH4+(aq) + H2O(l) ---> NH4OH(aq)
+ H+(aq)
Cl-(aq) + H2O(l) --->
c. Titrasi Asam Lemah dengan Basa Kuat
Reaksi antara 25 ml HC2H3O2 0,1 M (Ka=
1,74.10-5) dengan NaOH 0,1 M.
Reaksi : HC2H3O2(aq) +NaOH(aq) ---> C2H3O2Na(aq) + H2O(l)
Reaksi : HC2H3O2(aq) +NaOH(aq) ---> C2H3O2Na(aq) + H2O(l)
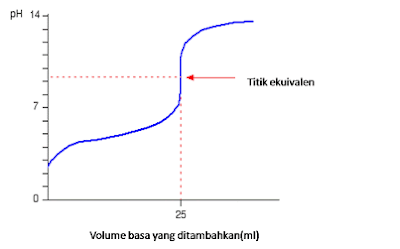 |
| Asam Lemah dengan Basa Kuat |
Penambahan 10 ml NaOH pH berubah menjadi 4,58, penambahan 25 ml terjadi
titik ekuivalen Pada pH = 8,72. Penambahan 26 ml NaOH pH =10,29. Pada grafik diatas, penambahan sedikit basa, maka pH akan naik sedikit, sehingga termasuk
larutan penyangga. Titik ekuivalen diperoleh pada pH >7. Hal itu disebabkan
garam yang terbentuk mengalami hidrolisis sebagian yang bersifat basa.
C2H3O2Na(aq)
---> CH3COO-(aq) + Na+(aq)
C2H3O2(aq)
+ H2O(l) ---> C2H3O2H(aq)
+ OH-(aq)
Na+(aq) + H2O(l)
--->
d. Titrasi Asam Lemah dengan Basa Lemah
Contoh yang biasa untuk kurva titrasi asam
lemah dan basa lemah adalah asam etanoat dan amonia
 |
| Asam Lemah dengan Basa Lemah |
CH3COOH
(aq) + NH3(aq) --->CH3COONH4 (aq)
Hal ini
juga terjadi karena keduanya bersifat lemah - pada kasus tersebut, titik
ekivalen kira-kira terletak pada pH 7. Gambar ini hanyalah penggabungan gambar yang telah anda lihat. Sebelum titik ekivalen sama seperti kasus amonia - HCl. Setelah titik ekivalen seperti bagian akhir kurva asam etanoat - NaOH.
Perhatian bahwa kurva tersebut sedikit tidak curam pada gambar ini.
Malahan, terdapat sesuatu yang dikenal dengan "titik infleksi".
Kecuraman yang berkurang berarti bahwa sulit melakukan titrasi antara asam
lemah vs basa lemah.






