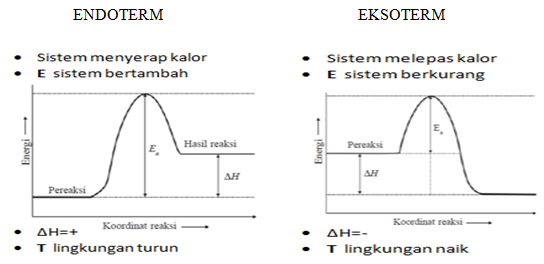
Reaksi endoterm adalah
reaksi yang disertai dengan perpindahan kalor dari lingkungan ke sistem (kalor diserap oleh sistem dari lingkungannya); ditandai dengan adanya
penurunan suhu lingkungan di sekitar sistem.
Reaksi eksoterm adalah
reaksi yang disertai dengan perpindahan kalor dari sistem ke lingkungan (kalor dibebaskan oleh sistem ke lingkungannya); ditandai dengan adanya
kenaikan suhu lingkungan di sekitar sistem.
Reaksi eksoterm pada umumnya berlangsung spontan, sedangkan reaksi endoterm tidak.
Pada reaksi endoterm :
DH = Hp – Hr > 0 ( bertanda positif )
Pada reaksi eksoterm :
DH = Hp – Hr < 0 ( bertanda negatif)
Contoh Reaksi Eksoterm dan Endoterm.
Reaksi Eksoterm merupakan reaksi yang melepaskan kalor dari sistem ke
lingkungan sementara itu Reaksi Endoterm merupakan reaksi yang menyerap
kalor dari lingkungan ke sistem.
Contoh Reaksi Eksoterm :
- Reaksi pembakaran
- Reaksi Respirasi
- Reaksi Pembentukan
- Reaksi Nuklir
- Reaksi netralisasi
- Reaksi karbit dengan air
- Reaksi alkana dengan asam
- Reaksi pembentukan molekul dari atom pada fase gas
- Batu kapur direndam dalam air
- Uap air menjadi hujan (kondensasi)
- Pencampuran air basa lemah
- Pencampuran air anhidrat
- Pembantukan air/salju di awan
- Uap air menjadi air
- Air menjadi Es
Contoh Reaksi Endoterm :
- Es menjadi air
- Air menjadi uap air
- Pelarutan urea dalam air
- Pembentukan kation dari sebuah atom dalam fase gas
- Pemanggangan ion
- Mencampurkan air dengan ammonium nitrat
- Memisahkan pasangan ion
- Mencairkan garam padat
- Karbon dipanaskan dengan uap Air
- Reaksi Fotosintesis
Contoh Soal
Reaksi Eksoterm
C(s) + O2(g) → CO2(g) + 393.5 kJ ;
ΔH = -393.5 kJ
*reaksi eksoterm terjadi karena ada perpindahan panas/kalor dari
lingkungan ke sistem. apa yg dimaksud dengan lingkungan atau sistem ?
segala sesuatu yang menjadi pusat perhatian dalam mempelajari
perubahan energi dan berubah selama proses berlangsung disebut sistem,
sedangkan lingkungan adalah yang di luar sistem.
contoh simplenya seperti ini guys : ketika kita menyalakan api
unggun, panasnya akan terasa ke kita walaupun kita tidak bersentuhan.
Kesimpulan:
1. Intinya yaitu jika melihat entalpi/ΔH negatif (-) berarti reaksi eksoterm
2. Gambar grafik anak panah selalu ke bawah (tanda -)
3. adanya perubahan kalor/panas yang didapatkan dari sistem. (sistem ke lingkungan)
Reaksi Endoterm
Pada reaksi terjadi perpindahan kalor dari lingkungan ke
sistem atau pada reaksi tersebut dibutuhkan panas. Pada reaksi endoterm
harga ΔH = positif ( + ) *alasan postif (+) karena kalor diambil dari
lingkungan
Contoh :
CaCO3(s) → CaO(s) + CO2(g)– 178.5 kJ ; ΔH = +178.5 kJ
*reaksi endoterm kebalikan dari reaksi endoterm, yaitu perpindahan kalor/panas dari lingkungan ke sistem.
contoh simplenya seperti ini : tangan yang terasa dingin ketika
bersentuhan dengan alkohol. *dikarenakan karena adanya perpindahan
kalor/panas dari alkohol (lingkungan) ke tangan (sistem) kita. tangan
kita sebagai sistem, alkohol bertindak sebagai lingkungan.
Kesimpulan:
1. Intinya yaitu jika melihat entalpi/ΔH positif (+) berarti reaksi endoterm
2. Gambar grafik anak panah selalu ke atas (tanda +)
3. adanya perubahan kalor/panas yang didapatkan dari lingkungan. (lingkungan ke sistem)
nah sekarang sudah tahu kan perbedaan dari kedua reaksi tersebut ..
mudah sekali kok mempelajarinya dan tidak rugi mempelajari ini karena
dalam dunia kimia kita tidak lepas dari kedua reaksi tersebut, kita
harus mengenal apa yang terjadi ini apakah reaksi eksoterm atau
endoterm.
tips mempeljarinya yaitu anda cukup belajar 1 reaksi aja, misalnya
pelajari betul-betul reaksi eksoterm, maka untuk reaksi endoterm adalah
kebalikannya.